No encontraste el producto? Escríbenos!

¿Qué es la citometría de flujo (análisis FACS)?
¿Qué es la citometría de flujo (análisis FACS)?
La citometría de flujo es una tecnología biofísica basada en la utilización de luz láser. Es decir, la citometría de flujo es un método analítico que permite la medición rápida de ciertas características físicas y químicas de células o partículas suspendidas en líquido que producen una señal de forma individual al interferir con una fuente de luz.
Esta luz es empleada en el recuento y clasificación de células según sus características morfológicas, presencia de biomarcadores, y en la ingeniería de proteínas.
Desarrollada originalmente a finales de la década de 1960, la citometría de flujo es una popular técnica analítica de biología celular que utiliza la luz para contar y perfilar las células en una mezcla de fluidos heterogénea. La citometría de flujo es un método especialmente potente porque permite al investigador recopilar de forma rápida, precisa y sencilla datos relacionados con muchos parámetros de una mezcla de fluidos heterogénea que contiene células vivas.
La citometría de flujo se utiliza ampliamente en las ciencias biológicas y biomédicas, y puede aplicarse en cualquier escenario en el que un investigador necesite perfilar rápidamente una gran población de células sueltas en un medio líquido. Por ejemplo, en inmunología la citometría de flujo se utiliza para identificar, separar y caracterizar varios subtipos de células inmunitarias en virtud de su tamaño y morfología.
Cuando se requiere información adicional, se pueden utilizar anticuerpos marcados con tintes fluorescentes y criados contra antígenos de la superficie celular altamente específicos (por ejemplo, grupos de diferenciación o marcadores de CD) para identificar y segregar mejor subpoblaciones específicas dentro de un grupo mayor.
En un citómetro de flujo
- Las células de la muestra pasan por un canal estrecho de una en una.
- Se utiliza luz para iluminar las células en el canal.
- Una serie de sensores detecta los tipos de luz que se refractan o emiten las células.
- Los datos adquiridos por los sensores se compilan e integran para construir una imagen completa de la muestra.
Diferentes tipos de luz utilizados en un experimento de citometría de flujo
Un citómetro de flujo utiliza luz refractada o emitida para contar e identificar células. Conozca los diferentes tipos de luz utilizados en un experimento de citometría de flujo en las siguientes figuras.
Dispersión frontal

La luz dispersa hacia delante es refractada por una célula del canal de flujo y continúa en la trayectoria de la luz (es decir, en la misma dirección en la que la luz viajaba originalmente). La luz dispersa hacia adelante es detectada por un sensor en la trayectoria de la luz, y se utiliza normalmente para identificar el tamaño de las partículas.
La luz dispersa hacia adelante se utiliza más comúnmente para detectar el tamaño del objeto en la trayectoria de la luz. Los objetos más grandes producirán más luz dispersa hacia adelante que los objetos más pequeños, y las células más grandes tendrán una señal de dispersión hacia adelante más fuerte
Dispersión lateral

La luz de dispersión lateral pasa de la fuente de iluminación al canal de flujo, es refractada por las células en una dirección que está fuera de la trayectoria original de la luz. La luz dispersa lateralmente es detectada por un sensor que es ortogonal a la trayectoria original de la luz.
La luz de dispersión lateral suele utilizarse para determinar la granularidad y la complejidad de la célula en la trayectoria de la luz. Las células muy granulares con una gran complejidad interna, como los neutrófilos, producirán más luz dispersa lateral y una señal de dispersión lateral más alta que las células con una granularidad y complejidad bajas.

Emisión de fluorescencia
La luz fluorescente es emitida por moléculas fluorescentes tras su excitación por un láser de longitud de onda compatible. La luz fluorescente puede provenir de materiales naturalmente fluorescentes en la célula, o puede provenir de tintes fluorescentes o anticuerpos marcados con fluorescencia que han sido utilizados para etiquetar una estructura específica en la célula.
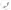
Análisis multiparamétrico
Un diagrama de puntos de citometría de flujo simulado, que representa la dispersión frontal frente a la lateral de una población de leucocitos. Las poblaciones celulares están marcadas por su probable identidad:
D Presuntos restos, elementos muy pequeños con baja dispersión frontal y lateral.
L/M Probables leucocitos/monocitos, células pequeñas o medianas con baja complejidad interna/granularidad. Estas células generan una intensidad de señal de dispersión frontal media y de dispersión lateral baja
G Probables granulocitos, células grandes con alta complejidad interna/granularidad. Estas células generan señales de dispersión frontal y lateral altas.
Aunque algunas identidades pueden confirmarse mediante perfiles de dispersión frontal y lateral, el etiquetado con un marcador específico del tipo de célula siempre proporciona una mayor resolución y certeza cuando se perfilan poblaciones complejas y heterogéneas de células.
Por ejemplo, en el gráfico anterior, un investigador puede ser capaz de distinguir entre granulocitos y linfocitos utilizando luz de dispersión frontal y lateral. Sin embargo, tres clases de granulocitos (neutrófilos, basófilos y eosinófilos) son muy similares en tamaño y estructura, lo que les confiere propiedades similares de dispersión de la luz. En este caso, los neutrófilos podrían ser marcados selectivamente en virtud de su expresión de un marcador específico de neutrófilos como el ELANE.
FACS: Clasificación de células basada en datos de citometría de flujo
Los términos citometría de flujo y clasificación de células activadas por fluorescencia (FACS) suelen utilizarse indistintamente. En la práctica, existen diferencias entre ambos métodos.
FACS es un derivado de la citometría de flujo que añade un grado excepcional de funcionalidad. Con FACS, un investigador puede clasificar físicamente una mezcla heterogénea de células en diferentes poblaciones.
Mediante el uso de anticuerpos altamente específicos marcados con colorantes fluorescentes, un investigador puede llevar a cabo un análisis FACS y reunir simultáneamente datos sobre una muestra y clasificarla según un número casi ilimitado de parámetros diferentes.
En un experimento FACS:
- Se recogen datos de dispersión frontal, lateral y fluorescente, como en la citometría de flujo convencional.
- Los parámetros definidos por el usuario proporcionan información sobre cómo deben clasificarse las células.
- En función de estos parámetros, la máquina FACS utiliza un electrodo para imponer una carga eléctrica a cada célula.
- Al salir de la cámara de flujo, los electroimanes clasifican las células por carga en recipientes separados.
¿Qué aspecto tienen los datos de citometría de flujo?
En un experimento de citometría de flujo, cada célula que pasa por el citómetro de flujo y es detectada será clasificada como un evento distinto.
Además, a cada tipo de luz detectada por el citómetro de flujo (dispersión frontal, dispersión lateral y cada longitud de onda de emisión de fluorescencia) se le asignará su propio canal. Los datos de citometría de flujo trazarán cada evento independientemente, y representarán la intensidad de la señal de luz detectada en cada canal para cada evento.
Los datos de citometría de flujo se representan normalmente de dos maneras: histogramas, que miden o comparan sólo un parámetro, y gráficos de puntos que comparan 2 o 3 parámetros simultáneamente en un gráfico de dispersión bidimensional o tridimensional.
Un histograma suele representar la intensidad detectada en un solo canal a lo largo de un eje y el número de eventos detectados a esa intensidad en un eje separado. Un gran número de eventos detectados a una intensidad particular se mostrará como un pico en el histograma.
Por el contrario, en un gráfico de puntos, cada evento se representa como un único punto en un gráfico de dispersión. Las intensidades de 2 canales diferentes (o 3 canales diferentes en un gráfico de tres dimensiones) se representan a lo largo de los distintos ejes. Los eventos con intensidades similares se agruparán en la misma región del diagrama de dispersión.
Nota: En los datos del diagrama de puntos, las muestras grandes a menudo resultarán en un grupo pesado de eventos representados en la misma región del diagrama. Hay muchos métodos para añadir resolución adicional a estas regiones. Por ejemplo, se puede utilizar un mapa de calor, como en el ejemplo anterior, para proporcionar información sobre la densidad de eventos en una región determinada del gráfico.
Tanto los histogramas como los gráficos de puntos ofrecen diferentes ventajas para el análisis de datos de citometría de flujo. La elección de la mejor forma de representar sus datos puede ayudar a garantizar que éstos cuenten una historia completa en un formato sencillo y comprensible.
Histogramas
- Son rápidos de leer y fáciles de entender.
- Son más útiles cuando sólo es importante un parámetro (por ejemplo, la intensidad de un solo canal de fluorescencia).
- La representación habitual incluye la intensidad de un solo canal (eje horizontal) frente al número de eventos detectados (eje vertical).
- Pueden utilizarse múltiples histogramas superpuestos para comparar un único parámetro de dos poblaciones de muestras diferentes (por ejemplo, experimental frente a control).
Gráficos de puntos
- Son más útiles cuando se necesita comparar datos multiparamétricos (por ejemplo, la intensidad de los canales de dispersión lateral frente a los de dispersión frontal).
- Pueden ser bidimensionales o tridimensionales
- La intensidad de cada canal se representa en su propio eje.
- Cada evento distinto se representa en un solo punto.
Son una representación más compleja e ilustrativa de los datos.
Los gráficos de puntos y los histogramas no son mutuamente excluyentes, y la mayoría de los experimentos complejos de citometría de flujo harán uso de múltiples gráficos para mostrar datos ricos y multiparamétricos sobre una muestra.
En muchos casos, es necesario trazar más de tres parámetros simultáneamente. En este caso, una técnica de análisis de datos conocida como gating puede ayudar a dar resolución y flexibilidad adicionales, permitiendo el análisis de una cantidad casi ilimitada de parámetros simultáneamente a través de varios gráficos de dispersión e histogramas diferentes.
La compuerta añade resolución a los datos de citometría de flujo
En resumen, el gating es un método para seleccionar las células de un experimento de citometría de flujo que se desea analizar con mayor detalle. El gating permite a un investigador reunir y mostrar más información sobre una subpoblación de células de lo que normalmente podría mostrarse en un gráfico de puntos de 2 o 3 dimensiones.
La separación añade resolución a un experimento de citometría de flujo y permite el análisis simultáneo de un número casi ilimitado de parámetros diferentes (canales).
En un experimento de citometría de flujo con gated:
- Un usuario recoge los datos de citometría de flujo de uno o más canales en un dot-plot.
- Basándose en los datos adquiridos, el usuario dibuja un cuadro de puerta seleccionando una subpoblación de células para su posterior análisis.
- La subpoblación de células dentro de la puerta se destacará específicamente en otros gráficos que muestren información de canales alternativos.
Las puertas añaden una increíble cantidad de flexibilidad a la citometría de flujo, garantizando una resolución de una sola célula para cada canal disponible para el investigador.
Pueden establecerse múltiples puertas para un solo gráfico de dispersión, y las puertas pueden “apilarse” y combinarse (es decir, una subpoblación de células con puertas en los canales 1 y 2 puede tener más puertas en los canales 3 y 4 para permitir una mayor especificidad y un análisis más profundo).

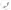
Una nota sobre la compensación
El spillover de un canal a otro puede causar señales identificadas falsamente como positivas. El desbordamiento es la señal artefactual que un colorante fluorescente puede causar en el canal de otro fluoróforo en función de su brillo relativo y su espectro de emisión. Aquí es donde entra en juego la compensación. La compensación es un procedimiento que aísla la señal de un canal concreto de los demás canales utilizados en el mismo experimento. El FITC, por ejemplo, tiene su pico de emisión en el rango verde del espectro electromagnético. Sin embargo, también emite fluorescencia en el canal amarillo, donde el PE emite luz. En pocas palabras, la compensación sustrae la señal del FITC del canal del PE.
Esta señal en el canal “equivocado” se resta de la señal causada por el fluoróforo de interés. En la muestra anterior, la relación entre el componente verde y el amarillo a una determinada longitud de onda de excitación es constante para el FITC. Por lo tanto, es posible inferir la cantidad de señal amarilla inespecífica de FITC en el canal PE a partir de la medición en el canal verde utilizando los coeficientes de compensación constantes. Lo mismo ocurre con el desbordamiento del PE en el canal FITC.
Puedes leer mucho más en nuestro blog


